Invokana
Presentaciones:
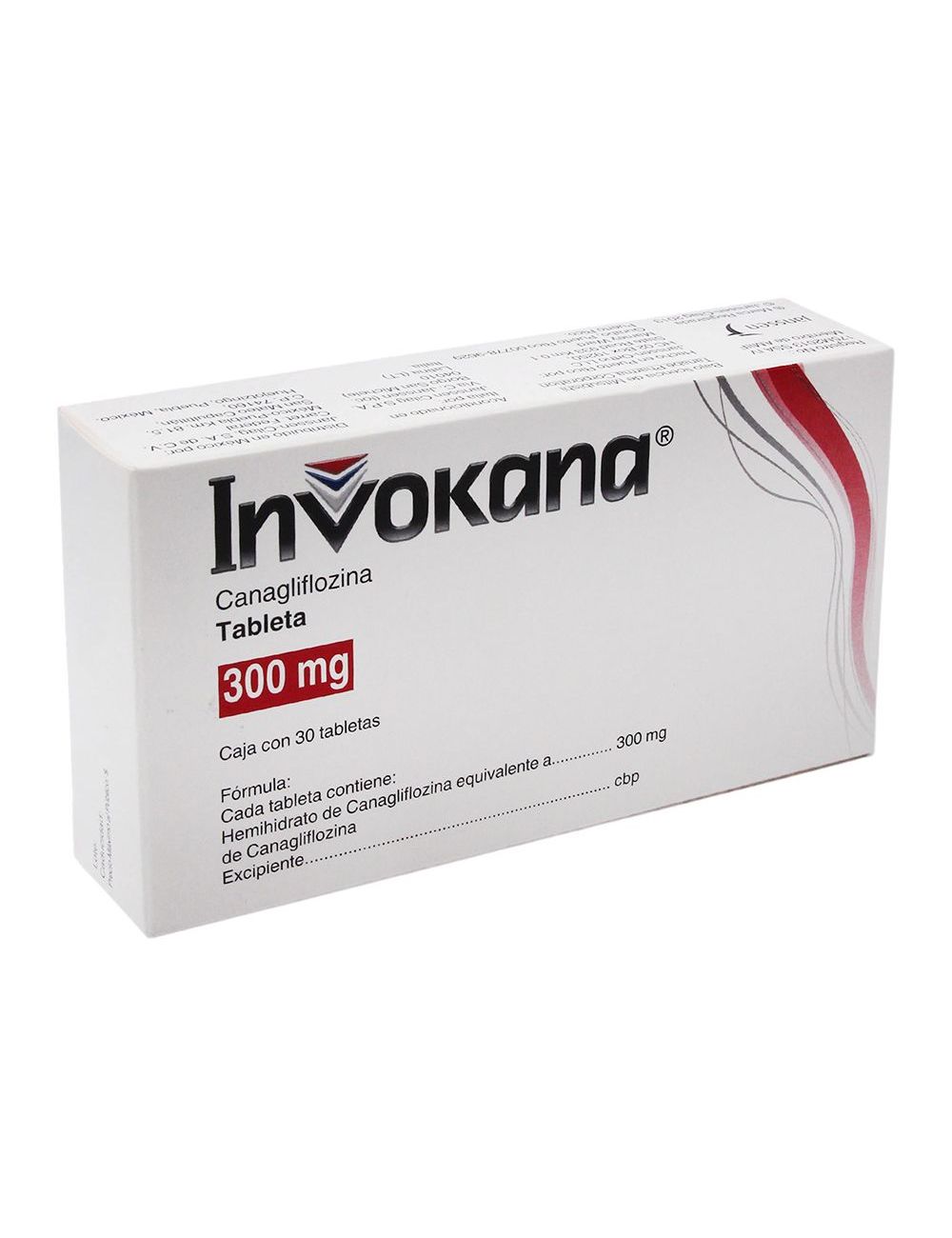
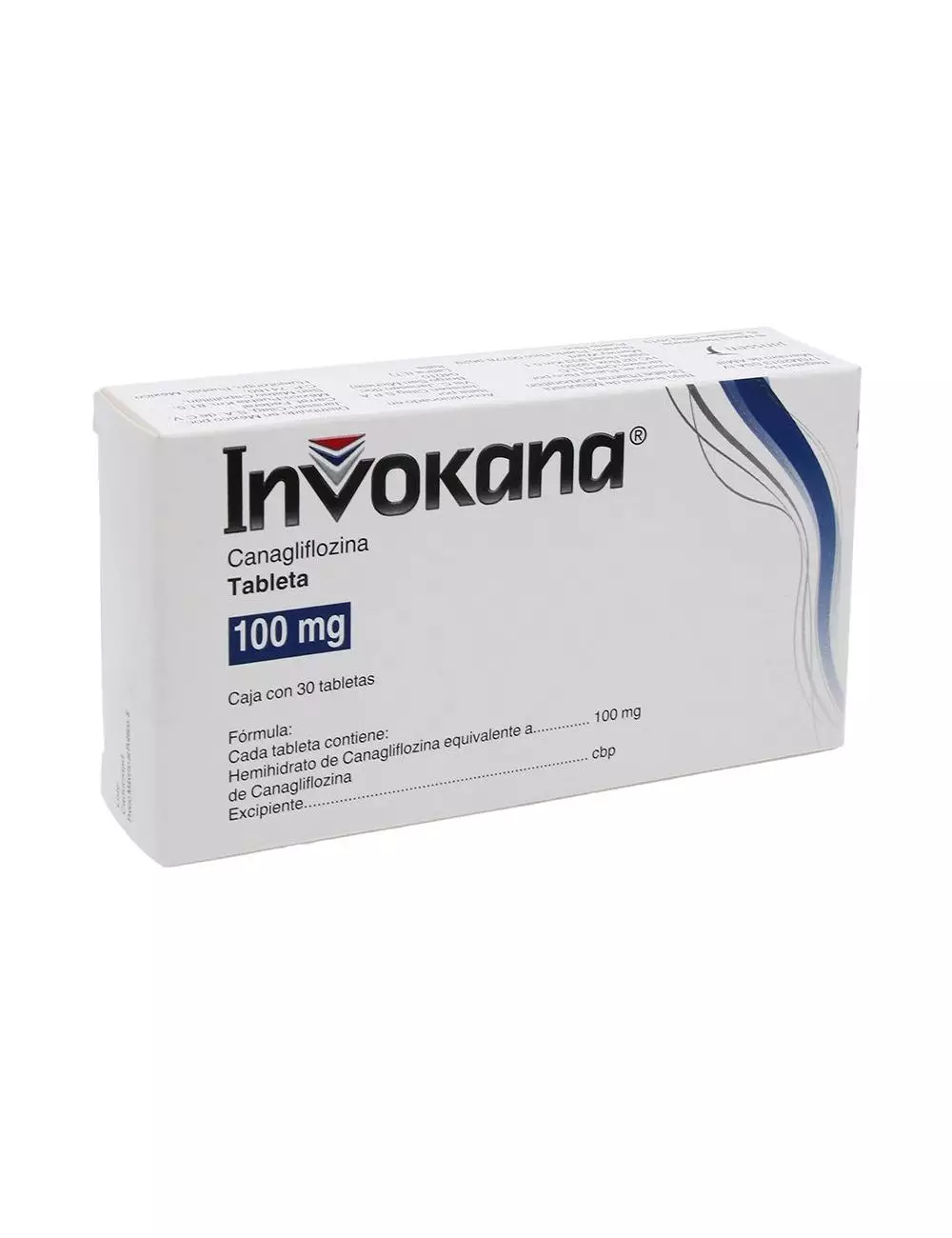
INVOKANA® caja con 30 tabletas con 100 mg INVOKANA® caja con 30 tabletas con 300 mg
Fórmula farmacéutica:
INVOKANA® Tabletas con 100 mg Cada TABLETA contiene:
Hemihidrato de canagliflozina equivalente a 100 mg de canagliflozina Excipiente, c.b.p.
INVOKANA® Tabletas con 300 mg Cada TABLETA contiene:
Hemihidrato de canagliflozina equivalente a 300 mg de canagliflozina Excipiente, c.b.p
Indicaciones:
Invokana tabletas, es un medicamento de marca (no genérico). Sirve como adyuvante a la dieta y el ejercicio para mejorar el control de la glucemia en adultos con diabetes mellitus tipo 2. Contiene (fórmula): Hemihidrato de canagliflozina equivalente de canagliflozina. Este producto es de venta con receta y su médico tratante debe señalarle la dosis de consumo Indicaciones y contraindicaciones aprobadas por el registro COFEPRIS Y PLM.
Recomendaciones sobre almacenamiento:
Consérvese a temperatura ambiente a menos de 30°C y en lugar seco.
Información adicional:
No se administre a menores de 18 años. Su venta requiere receta médica. No se deje al alcance de los niños. No se use durante el embarazo y lactancia.
Reg. Núm. 175M2013, SSA IV
- Información exclusiva para profesionales de la salud
- No te automediques
- Consulte a su médico