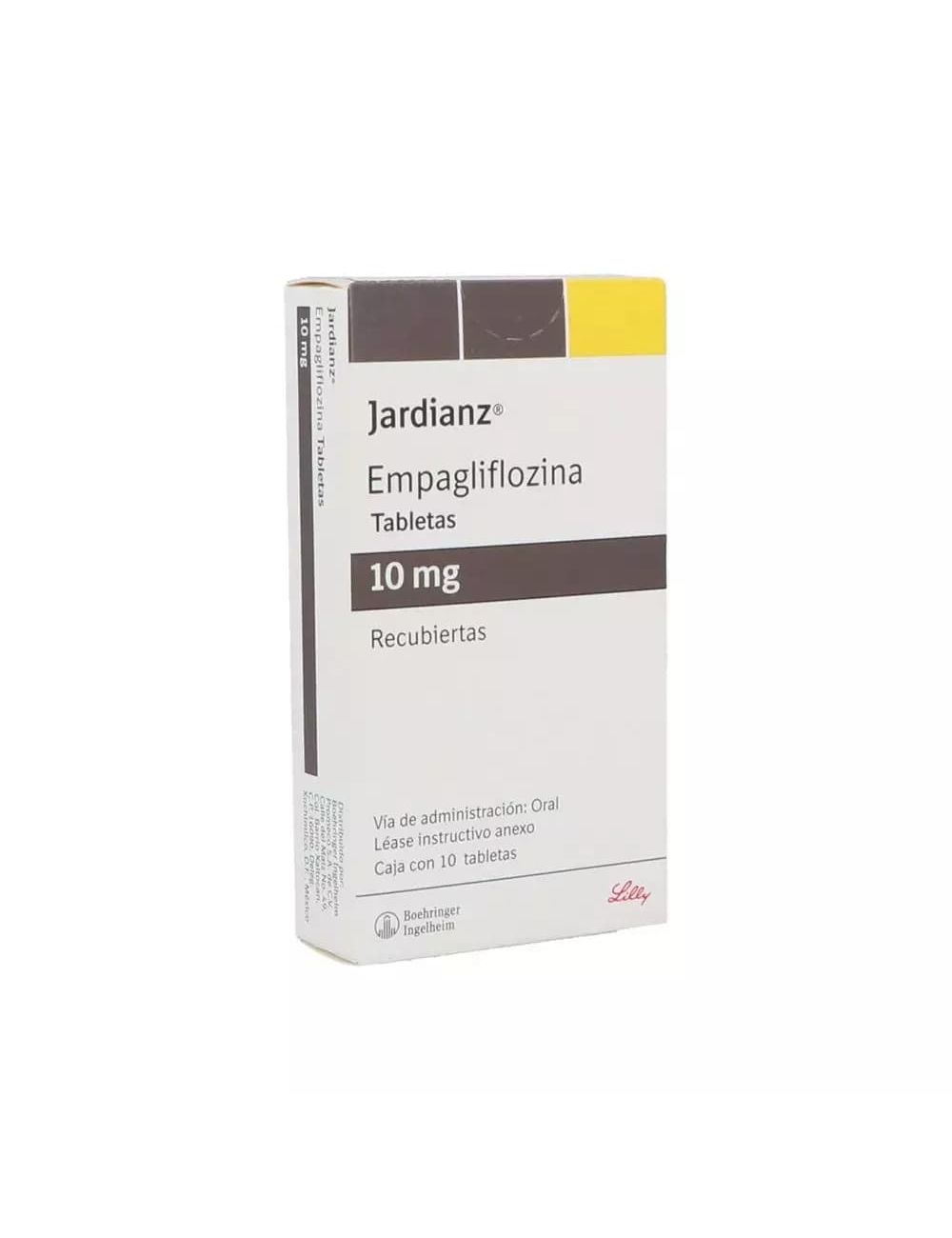
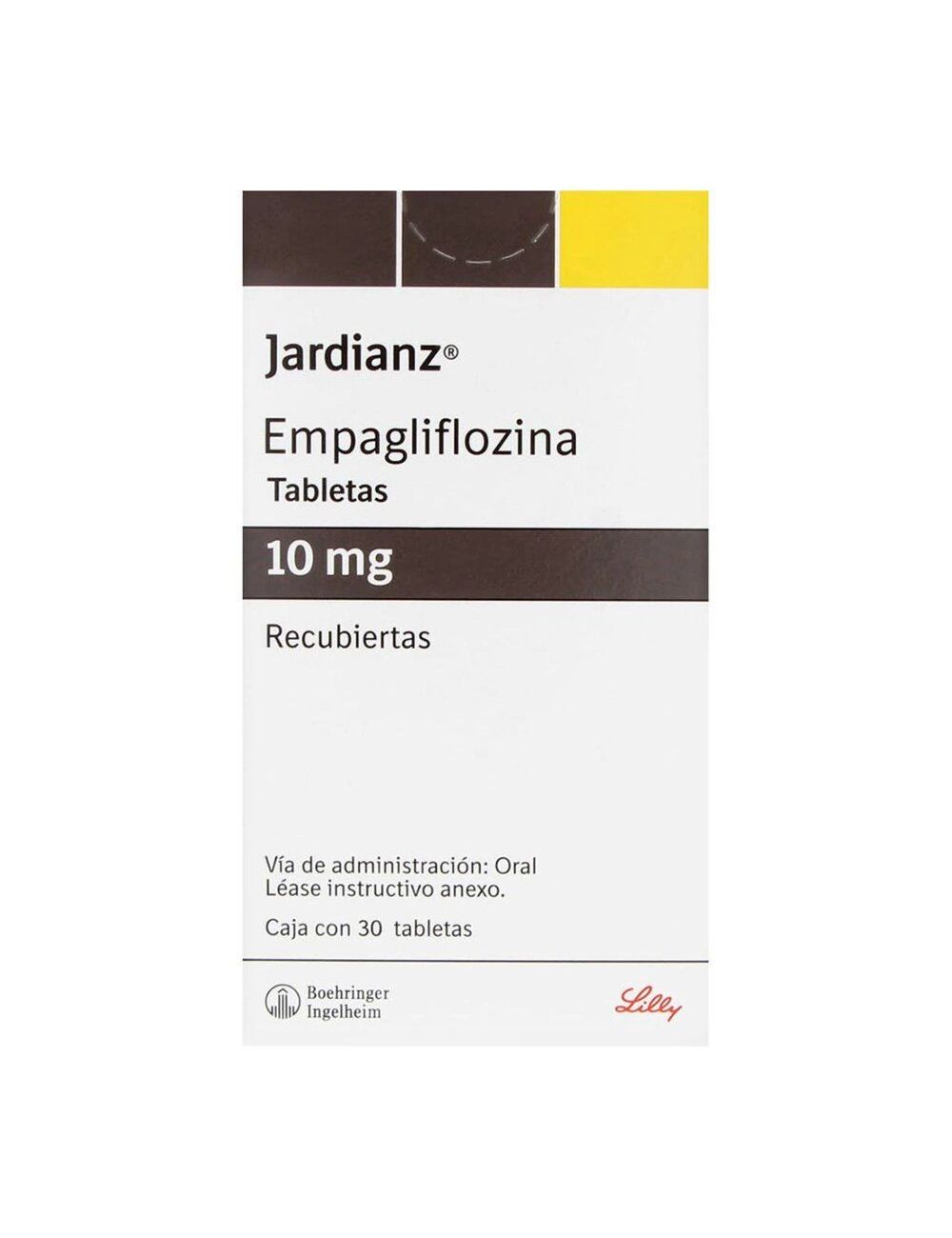
Jardianz
Presentaciones:
Caja con 10 tabletas recubiertas de 10 mg
Caja con 30 tabletas recubiertas de 10 mg
Caja con 10 tabletas recubiertas de 25 mg
Caja con 30 tabletas recubiertas de 25 mg
Fórmula farmacéutica:
Cada tableta recubierta contiene: Empagliflozina 10 mg 25 mg 1 tableta
Excipiente, c.b.p. 1 tableta
Indicaciones:
Jardianz es un medicamento de marca (no genérico). Sirve para el tratamiento de diabetes mellitus tipo 2 en combinación con dieta y ejercicio, ya sea como monoterapia o como tratamiento complementario adicionado a otros tratamientos antidiabéticos orales o insulina.
Este producto es de venta con receta y su médico tratante debe señalarle la dosis de consumo Indicaciones y contraindicaciones aprobadas por el registro COFEPRIS Y PLM. tratante debe señalarle la dosis de consumo Indicaciones y contraindicaciones aprobadas por el registro COFEPRIS Y PLM.
Recomendaciones sobre almacenamiento:
Consérvese a temperatura ambiente a no más de 25°C.
Información adicional:
Reg. Núm. 212M2014, SSA IV
- Información exclusiva para profesionales de la salud
- No te automediques
- Consulte a su médico