Vfend
Presentaciones:
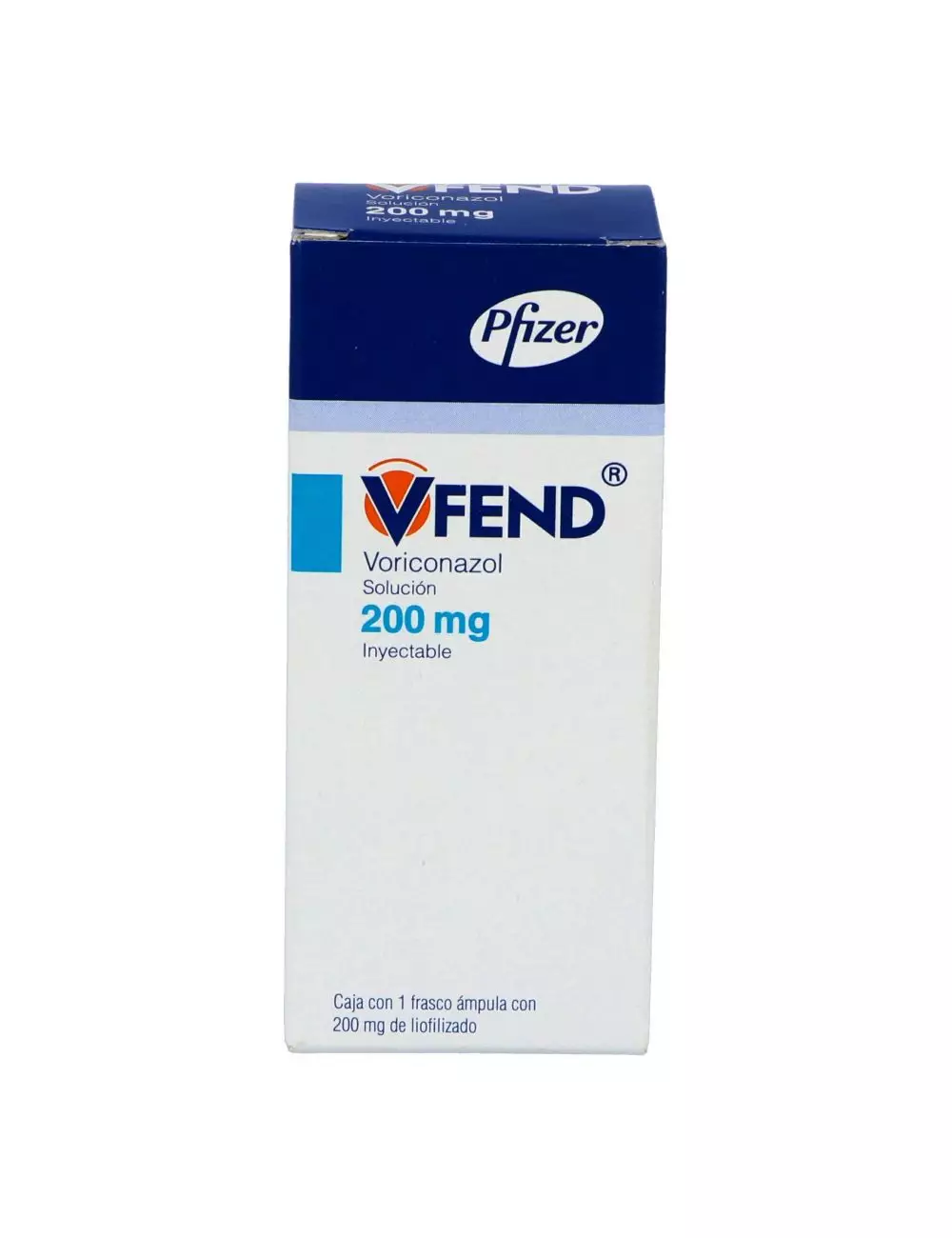
Vfend solución inyectable caja con frasco ámpula 200 mg
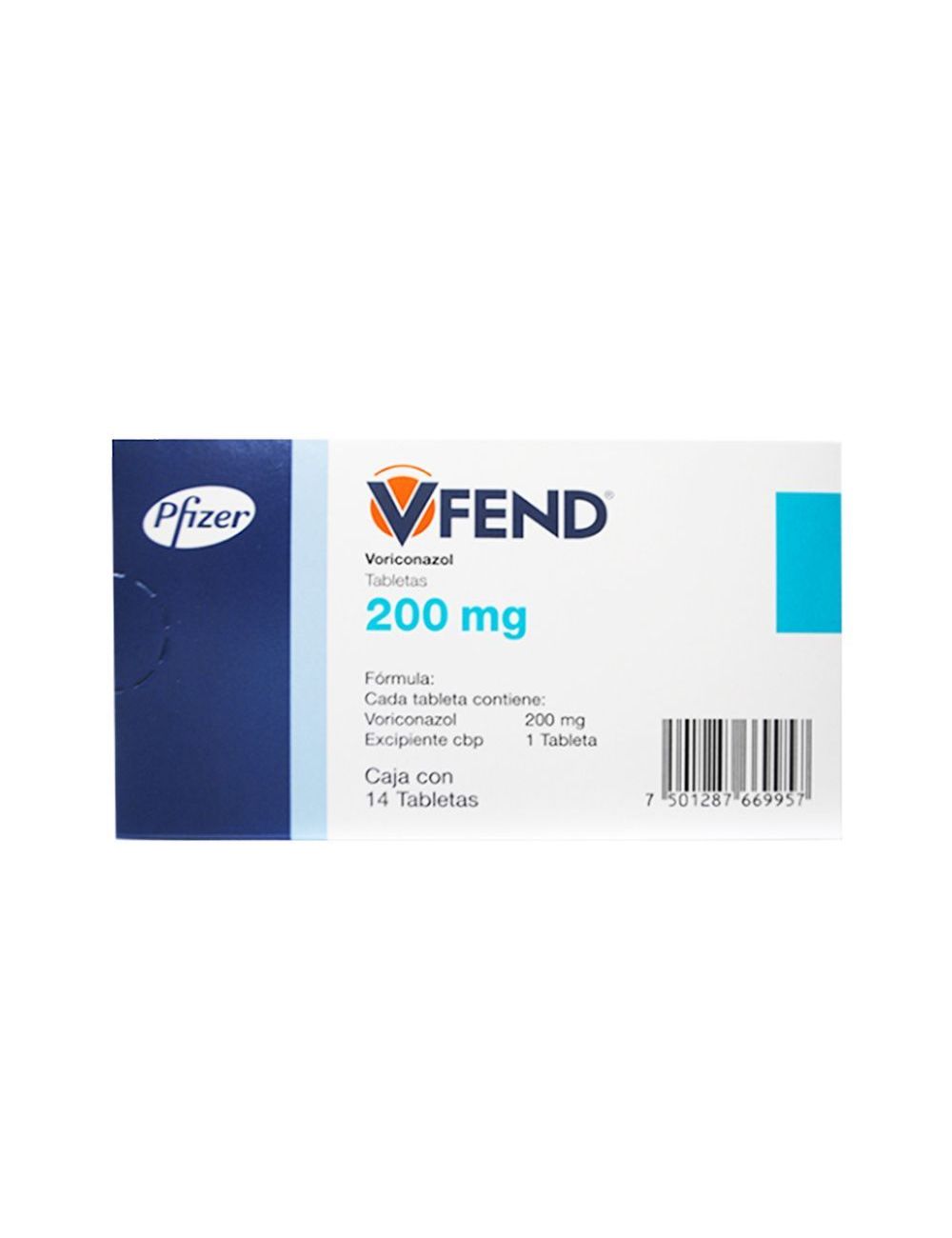
Vfend caja con 14 tabletas 200 mg
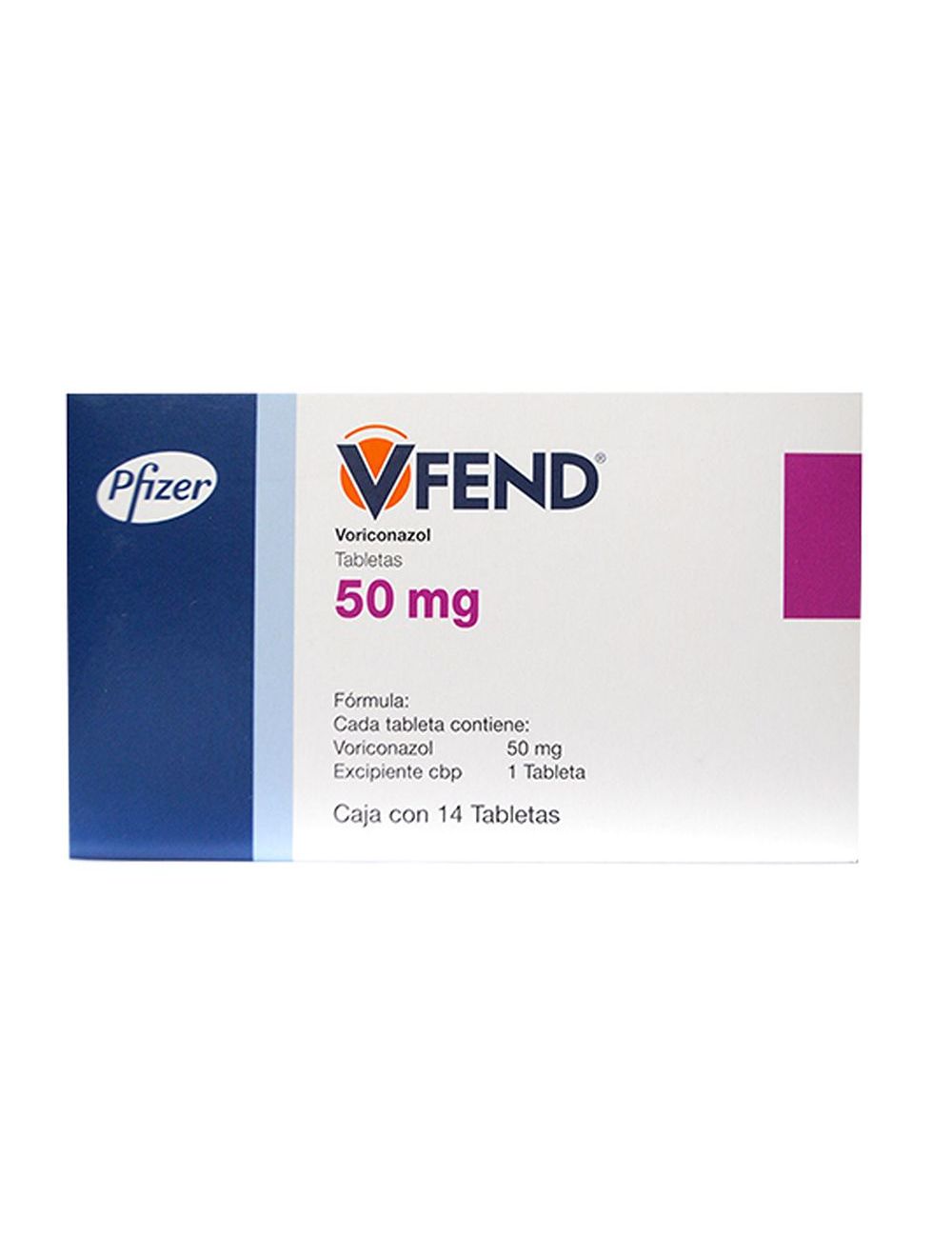
Vfend caja con 14 tabletas 50 mg
Fórmula farmacéutica:
Caja con frasco ámpula con 200 mg de voriconazol.
Cajas con tabletas con 50 y 200 mg.
Indicaciones:
Vfend, el voriconazol es un agente antimicótico triazólico de amplio espectro que tiene las siguientes indicaciones:
• Tratamiento de aspergilosis invasiva.
• Tratamiento de candidemia en pacientes no neutropénicos.
• Tratamiento de infecciones serias invasivas por Candida (incluida la C. krusei).
• Tratamiento de candidiasis esofágica.
• Tratamiento de infecciones micóticas serias causadas por Scedosporium spp. y Fusarium spp.
• Tratamiento de otras infecciones micóticas serias en pacientes que tienen intolerancia o son refractarios a otras terapias.
• Prevención de la penetración de infecciones micóticas en pacientes de alto riesgo febriles (trasplantes alógenos de médula ósea, pacientes con recaída por leucemia).
Recomendaciones sobre almacenamiento:
Consérvese a temperatura ambiente a no más de 30°C y en lugar seco.
Información adicional:
No se deje al alcance de los niños. Su venta requiere receta médica. No ingerible. Evite el contacto con los ojos y mucosas. Antibiótico. El uso incorrecto de este producto puede causar resistencia bacteriana.
Reg. Núm. 320M99, SSA
- Información exclusiva para profesionales de la salud
- No te automediques
- Consulte a su médico