DATOS IMPRESOS DEL MÉDICO
1) Nombre completo de médico
2) Cédula profesional
3. Domicilio
4) Telefono
5) Universidad o institución que emitió su título
MÁS DATOS DE MÉDICO
6) Firma del médico: Esta puede ser autógrafa.
7) Fecha de expedición de la receta (para medicamentos antibióticos se tomará en cuenta la vigencia y validez de la receta a partir de la fecha de expedición, dada por el profesional de la salud que la expide) (De acuerdo con el art. 30 de la LGS y el suplemento de la FEUM 2020).
DATOS DEL PACIENTE
8) Nombre
9) Edad
10) Fecha de nacimiento
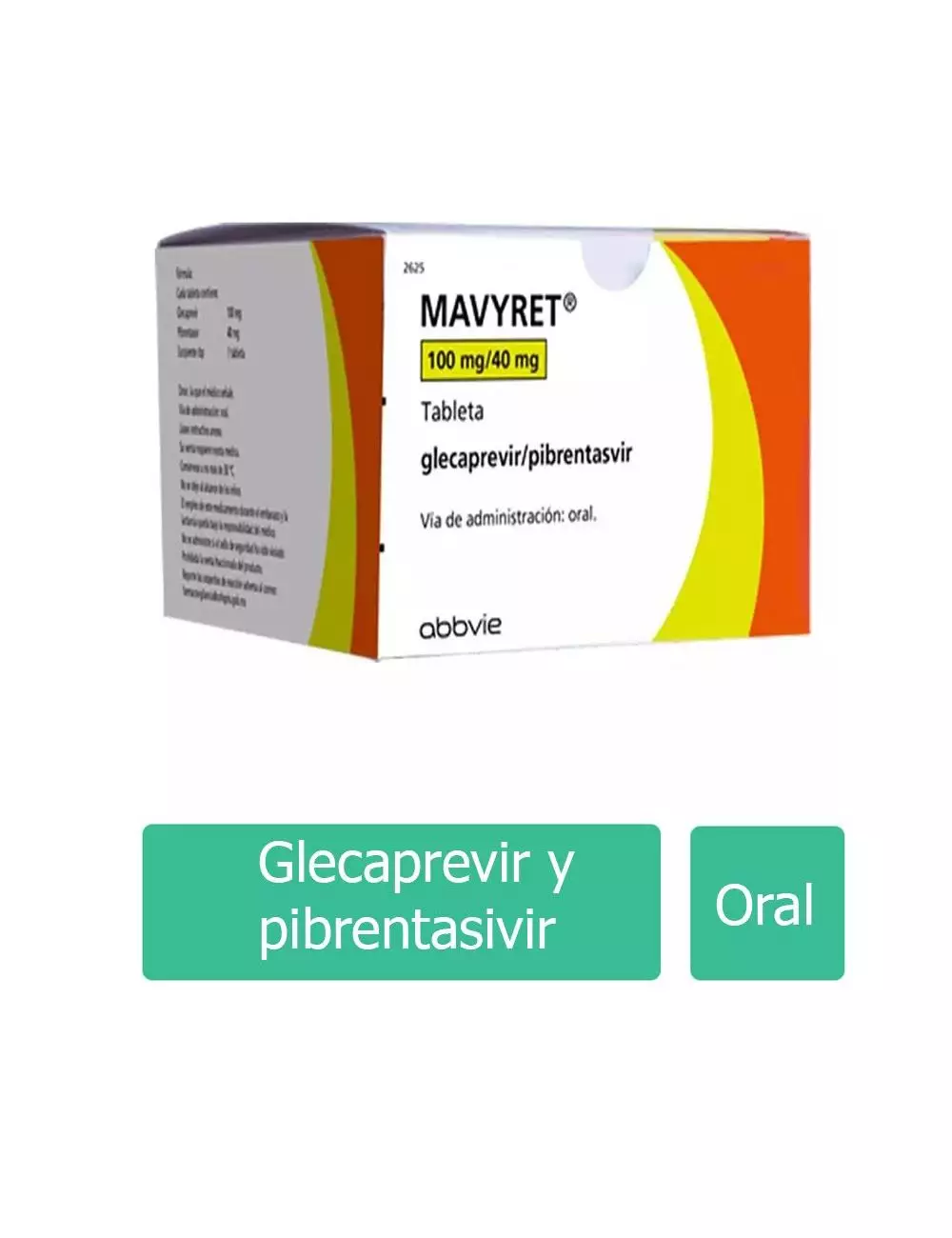
DATOS DEL MEDICAMENTO
11) Denominación genérica (Denominación distintiva es opcional)
12) Presentación (Concentración y forma farmacéutica; Ejemplo Terfamex 15 mg caja con 30 cápsulas)
13) Cantidad por surtir
14) Dosis, frecuencia y duración del tratamiento (Ejemplo: Tomar una cápsula cada 24 hrs por 30 dias)
15) Vía de administración (Ejemplo: Via oral, intravenoso, etc)
NOTAS:
NOTA1: recetas de instituciones públicas (hospitales, clínicas, centros de salud, etc) pueden llevar escritas a mano el nombre, Cédula Profesional, firma autógrafa del médico, y obligatoriamente tener sello oficial de la institución donde se expide la receta (antibioticos no se necesita el sello institucional, solo para controlados).